ヒトゲノムプロジェクトが終了しほぼ全てのヒト遺伝子の塩基配列が明らかになった現在、これらの遺伝子から発現してくる様々なタンパク質を解析することが、これからの医学・生物学などの発展にとって非常に重要となっている。タンパク質の細胞内動態をリアルタイムで可視化することは、それらのタンパク質の局在や相互作用、発現誘導などを明らかにし生体現象の複雑な制御を解明していく上で有力な手がかりとなる。
1960年代にオワンクラゲから発見されたGFP(Green Fluorescent protein)は自ら発色団を形成して発光するタンパク質で、遺伝子発現のレポーターやタンパク質の局在などの視覚マーカーとして多くの研究に用いられてきた。GFPは238個のアミノ酸ポリペプチド鎖がβシートを成し、中に発色団を持つコンパクトなバレル構造をしている。このバレル構造のためGFPは細胞内で非常に安定であるが、この特性は代謝回転の速さの異なる細胞内現象を正確にモニターするためには逆に不利である。そこでタンパク質分解シグナルとして、半減期がわずか30分という最も短命なタンパク質の1つであるマウスのオルニチンデカルボキシラーゼ(mouse ornithine decarboxylase, mODC)がC末端に持つタンパク質不安定化配列を、GFPなど蛍光タンパク質のC末端に結合させることで半減期を約2時間にしたd2GFPが開発された。さらにそのmODCの不安定化配列にmutationを加えて半減期をそれぞれ1時間と4時間にしたd1GFP、d4GFPなども開発された。こうして異なる細胞内半減期を持ついくつかの蛍光タンパク質が作られたが、幅広い細胞内現象に対応するにはまだ不十分であった。
[目的]
不安定化配列に様々な改変を加えたものを作製し、これらの蛍光タンパク質を当研究室のEBベクターに組み込んでヒト細胞に発現させ、蛍光強度の変化をモニターしながら分解速度について解析を行う。
またRnase Aから発見されたmODCとは異なる分解経路にタンパク質を誘導すると考えられているシグナル配列であるKFERQを、蛍光タンパク質のそれぞれN末端とC末端に結合させたベクターを作製し、同様に解析を行う。
[実験材料と方法]
mODCの不安定化配列に数種類のdeletionを導入するようにいくつかプライマーを設計し、PCRによってオリゴヌクレオチド断片を増やした。これらの断片を、当研究室で開発されたEpstein-Barr virus vector(EBベクター)にd2GFPを組み込んだpOSTet14d2Gに挿入し、FuGENE6を用いてHEp2細胞にトランスフェクションした。薬剤で4日間セレクションした細胞をフローサイトメトリーや蛍光顕微鏡を用いて解析を行った。またd2GFPだけでなくd1GFP・d4GFP・d2Venus・d1Venus(※)でも同様にして解析を行った。
KFERQ配列についてもこの配列を導入するようにプライマーを設計し、pOSTet14Venusを用いて上記と同様の方法で解析を行った。
※VenusはGFPにmutationを加えて開発された黄色蛍光タンパク質である。
[結果と考察]
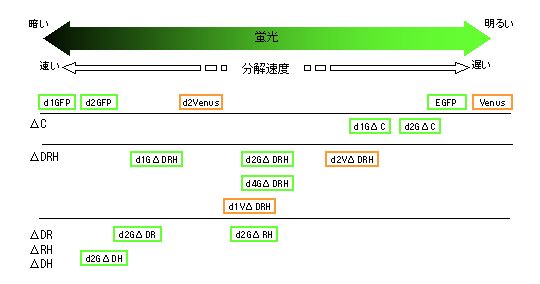
それぞれをフローサイトメトリーで解析した結果から、作製した不安定化蛍光タンパク質は最も短い半減期のd1GFPから長い半減期を持つVenusの間で、図のように様々な長さの半減期を持つことがわかった。このような一連の異なる半減期を持つ蛍光タンパク質を用いて、どのような細胞内現象をモニターしていくかが今後の課題である。
また、KFERQ配列をN末端に挿入したVenus(nKFERQ)ではcontrolに比べ分解速度がわずかに速くなっているようだったが、C末端に挿入したもの(cKFERQ)では極端に分解速度が速くなっていた。これらを蛍光顕微鏡下で観察したところ、nKFERQのVenusは核小体を除いた細胞全体に局在していたが、cKFERQのVenusでは局在が核周辺のERと思われる場所に偏っていた。現在この偏局在が本当にERであるかどうかについて、ER局在シグナルをつけた蛍光タンパク質ベクターと免疫染色の両方を用いて解析中である。