|
つくば生物ジャーナル Tsukuba Journal of Biology (2005) 4: TJB200501200100787
MafB,c-Mafダブルノックアウトマウスの表現型解析
長谷川 和輝(筑波大学 生物学類 4年) 指導教員: 高橋 智 (筑波大学 人間総合科学研究科)
【 背景・目的 】
大Maf 群転写因子は、レトロウイルスAS42から単離された癌遺伝子v-mafの細胞関連遺伝子であり、マウスでは現在までにc-Maf, MafB, MafA, Nrlの4種類が同定されている。大Maf群転写因子は、そのN末端側に転写活性化能を有する酸性ドメインを持ち、これを持たない小Maf群転写因子とは区別される。またC末端側には塩基性ドメインとロイシンジッパードメインからなるbZIPドメインを持っており、このbZIPドメインを介してホモダイマーやヘテロダイマーを形成し、Maf認識配列へと結合することによって遺伝子発現を制御している。当研究室ではc-Maf、及びMafB欠損マウスをそれぞれ作製、解析しており、c-Maf欠損マウスは眼の発生における水晶体繊維細胞の分化や、T細胞によるIL-4の産生などに異常が見られる。またMafB欠損マウスは腎糸球体足細胞における足突起の欠如や平衡感覚を司る内耳の形成不全、さらに延髄呼吸中枢ニューロンの発生異常などが見られる。この2種類の遺伝子欠損マウスは、共に生後直後で死亡してしまう。
小Maf群転写因子を始めいくつかの遺伝子群では、ファミリー遺伝子を複数個欠損させることによって単独欠損マウスではあらわれなかった表現型が顕在化することがわかっている。これまでの研究から、少なくともマクロファージではMafBとc-Mafが共に発現していることが判明していたが、MafBとc-Mafの発生過程における詳細な発現パターンの解析が成されていない組織も多く、MafBとc-Mafを共に欠損させることによって表現型が重篤化したり、新たな異常が生じる可能性があった。従って本研究ではMafB-/-::c-Maf-/-マウスを解析することにより、それぞれの単独欠損マウスではわからなかったin vivoでのMafBとc-Mafの機能を解明することを目的とする。
【方法】
MafB+/-::c-Maf+/-マウス同士を交配し、胎生10.5日〜胎生12.5日のMafB-/-::c-Maf-/-胎児を得た。これを材料として以下のような実験を行った。
・HE染色
胎児のパラフィン切片を作製したあと、ヘマトキシリンとエオシンで細胞を染色して組織の観察を行った。
・TUNEL染色
胎児のパラフィン切片を作製し、FITCでラベルしたdUTPをターミナルデオキシヌクレオチジルトランスフェラーゼを用いてDNA断片3'側に付加した。
さらにHRPの結合したanti-FITC抗体を作用させた後、HRPの基質であるDABで発色させてアポトーシス細胞を可視化した。
・コロニーアッセイ
胎生10.5日の卵黄嚢と胎生12.5日の肝細胞を、増殖を促すいくつかのサイトカインを加えたメチルセルロース培地にまいて、成長してきた赤血球系のコロニー(
CFU-E)数を計測した。
【結果・考察】
MafB+/-::c-Maf+/-マウス同士を交配してc-Maf-/-::MafB-/-マウスを作製したところ、胎生12.5日では貧血の症状を示し(図1)、それぞれの単独欠損マウスよりも早期の胎生中期で致死となることがわかってきた。次に、貧血の原因を探るため組織学的な解析を行ったところ、二次造血の場である肝臓で赤血球系の細胞がアポトーシスを起こしていることが明らかとなった。胎生12.5日の肝細胞でコロニーアッセイを行ったところ、野生型に比べて肝細胞数あたりのCFU-Eの数が増加していた。しかしながら、胎生10.5日の卵黄嚢でコロニーアッセイを行った場合は野生型との違いは見られなかった。これらの結果から、MafB-/-::c-Maf-/-マウスで見られた赤血球系細胞のアポトーシスは、赤血球自体に原因があるのではなく、胎児肝臓における微小環境の破綻が原因であると考えられる。今後は、MafB-/-::c-Maf-/-マウスの肝臓においてアポトーシスが起こる詳細な分子メカニズムを解析していく予定である。
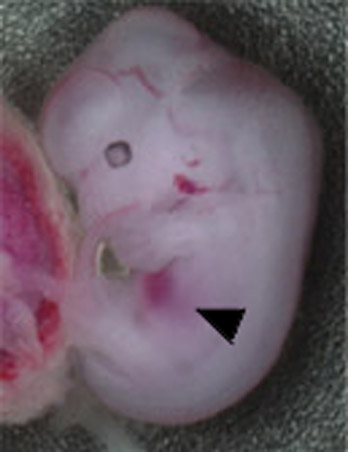 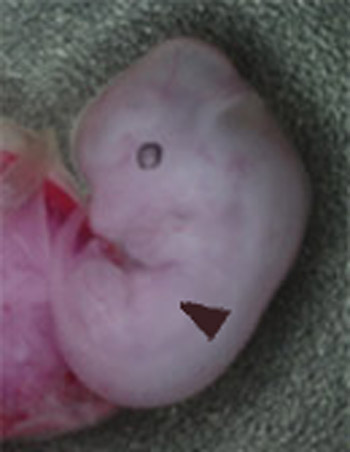 図1 胎生12.5日 MafB+/-::c-Maf+/-(左)と
図1 胎生12.5日 MafB+/-::c-Maf+/-(左)と
MafB-/-::c-Maf-/-(右)の胎児。
コントロール(左)に比べて、ダブルノックアウトマウス(右)は肝臓(矢頭)が白く、身体の大きさも小さい。
©2005 筑波大学生物学類
|