|
つくば生物ジャーナル Tsukuba Journal of Biology (2005) 4:
TJB200501200100794
超好熱菌由来メチオニンアミノペプチダーゼの解析
藤村 崇 (筑波大学 生物学類 4年) 指導教員: 小林 達彦 (筑波大学 生命環境科学研究科)
[背景・目的]
タンパク質の翻訳は、リボソームにおいてmRNA上の開始コドンAUGに対応して、メチオニンから開始される。しかし、全ての生物において成熟したタンパク質がN末端にメチオニン残基を保持しているとは限らず、多くのタンパク質では、タンパク質の合成途中で除かれ、除去されたメチオニンはサルベージ回路にて再利用される。メチオニンアミノペプチダーゼ(MAP)は、翻訳の初期段階にあるタンパク質の開始メチオニンを切断する酵素であり、その切断活性は開始メチオニンの隣のアミノ酸の種類に依存している。
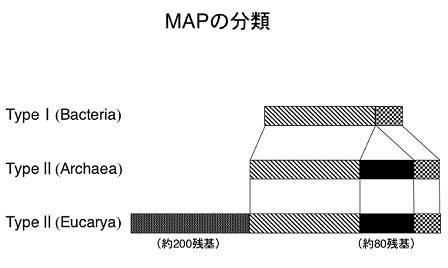
生物界はバクテリア(Bacteria)、アーキア(Archaea)、ユーカリア(Eucarya)から成る3つのドメインに分けられており、アーキアはバクテリアから分岐し、更にユーカリアはアーキアから分岐したとされている。現在、バクテリアを始めアーキア、ユーカリア由来の多くのMAPが発見され、そのアミノ酸配列から、タイプIとタイプIIの二種類に分類されている。バクテリアはタイプI、アーキアとユーカリアはタイプIIに属する(下図)。バクテリア同士の共生によって、ユーカリアが進化してきたと言う細胞共生説を裏付けるように、ユーカリアのミトコンドリア由来のMAPは、ユーカリアよりもむしろ、バクテリアのMAPに近縁である。アーキア由来のMAPはタイプIIに属するが、ユーカリア由来のMAPのようなN末のアミノ酸残基は存在せず、バクテリアとユーカリアの中間の様相を呈している。
MAPによって全てのタンパク質の開始メチオニンが切断されるわけではなく、その生理的意義は不明である。そこで、全ゲノム配列が明らかにされている超好熱菌からMAP遺伝子を取得し、MAPの酵素学的諸性質を明らかにすると共に、データベース上の全タンパク質の成熟後における開始メチオニンの有無を、MAPの酵素学的諸性質から判別し分類することで、MAPの意義を検討する。
[方法・結果]
ゲノムデータを基にプライマーをデザインし、調製した染色体DNAを鋳型にしたPCR法によりMAP遺伝子を取得した。大腸菌で本酵素を大量発現させるために、発現用ベクターpET-21a(+)に本酵素遺伝子を挿入し発現プラスミドを取得した。シーケンスにより本遺伝子の配列を確認後、大腸菌BL21(DE3)CodonPlusRILを形質転換しMAPの大量発現を試みた。
前培養した形質転換体を2YT培地(50μg/ml アンピシリン、30μg/ml クローラムフェニコール)に1 %
植菌した。OD660≒0.4時にIPTG(終濃度1 mM) を添加し、4
時間培養後、集菌した。菌体を超音波破砕、熱処理(80度、20
分)し遠心後、上清を回収した。SDS-PAGEに供したところ、本酵素の発現を確認できた。現在、MAPの精製を試みている。
©2005 筑波大学生物学類
|