|
つくば生物ジャーナル Tsukuba Journal of Biology (2005) 4:
TJB200501200100795
PI3K SH3ドメインのペプチド認識におけるTyr14の役割
古板恭子 (筑波大学 生物学類 4年) 指導教員:田中俊之 (筑波大学 生命環境科学研究科)
〈はじめに〉
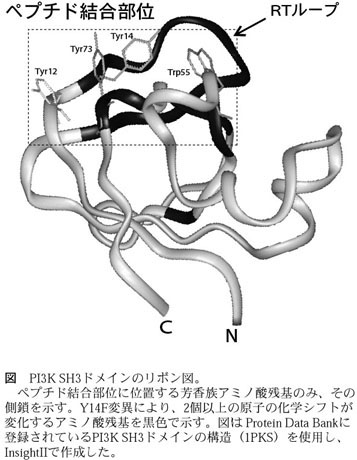
SH3ドメインは、タンパク質のプロリンに富む領域と特異的に結合して、タンパク質−タンパク質間の相互作用を制御する機能ドメインであり、細胞内シグナル伝達に関与するタンパク質に広く見出されている。そのペプチド結合部位には、標的ペプチドと疎水的な相互作用をする芳香族アミノ酸残基が良く保存されている。本研究の対象であるphosphatidylinositol 3-kinase(PI3K)のSH3ドメインでは、Tyr12、Tyr14、Trp55及びTyr73がそれに当たる(1,図)。このうちTyr14をPheに置換すると、標的ペプチドの解離定数が19 μMから7 μMに減少し、かつその結合様式が変化することが示されている(2)。これらのことから、Tyr14が、PI3K SH3ドメインのペプチド認識において重要な役割を果たしている可能性が高いと考えられる。そこで、PI3K SH3ドメインのY14F変異体のNMR解析を行い、Tyr14がペプチド結合部位の構造にどのように貢献しているかを調べることにした。
〈方法〉
当研究室で既に確立されたY14F変異体の大腸菌による発現系を用い、LB培地を用いて非標識Y14Fを、また、炭素源と窒素源としてそれぞれ13C-Glucoseと15NH4Clのみを含むM9培地を用いて13C/15N標識Y14Fを大量発現し、改良を加えた既存の方法に従って精製した。得られた非標識Y14Fを用いて2D NOESYスペクトルを、13C/15N標識Y14Fを用いて 1H-15N HSQC、1H-13C CT-HSQC、HNCO、CBCACONH、HNCACB、CCONH、HBCBCACOCAHA及びHCCH-TOCSYの各NMRスペクトルを測定した。
〈結果と考察〉
上記のNMRデータを一般的な手順に従って解析し、Y14F変異体の主鎖原子の連鎖帰属と側鎖原子の帰属を行った。得られた主鎖アミド水素とアミド窒素、α炭素及びβ炭素の化学シフト値を、野生型(WT)のものと比較したところ、Y14F変異により、2個以上の原子の化学シフトが変化するアミノ酸残基が19個存在した。そのうち8個はペプチド結合部位に位置し、残りの大部分はそれに隣接するアミノ酸残基であった(図)。化学シフト値は、その原子核が置かれている化学的環境により異なる。すなわち、化学シフトの変化は、その原子の周辺に分子構造の変化が起こっていることを示す。従って、Y14F変異は、ペプチド結合部位、特にRTループと呼ばれる領域(Lys15-Glu20)に強く影響していることが分かった。次に、ペプチド結合部位に存在する芳香族アミノ酸残基の芳香環水素の化学シフト値をWTのものと比較した。その結果、Tyr12とTyr73では化学シフト値が変化しないが、RTループ近くに位置するTrp55では、その半数の化学シフト値が変化することが分かった。以上の結果から、Tyr14は、RTループ周辺のペプチド結合部位の構造を適切に維持するために、重要な役割を果たしていると考えられる。今後、Y14F変異体の三次元構造を決定し、WTの構造と比較することによって、Tyr14の構造上の役割を詳細に明らかにする予定である。
※水素では0.05 ppm以上、窒素あるいは炭素では0.10 ppm以上、化学シフト値が異なる場合を「変化あり」とした。
REFERENCES
1.Koyama et al., Cell, 72, 945-952, 1993
2.Okishio et al., Biochemistry, 40, 15797-15804, 2001
©2005 筑波大学生物学類
|