|
つくば生物ジャーナル Tsukuba Journal of Biology (2006) 5: TJB200601200200730
両生類視細胞外節におけるcGMP依存チャネルの解析
大高 舞 (筑波大学 生物学類 4年) 指導教員: 中谷 敬 (筑波大学 生命環境科学研究科)
導入動物は光刺激を網膜の視細胞で受容し、電気信号に変換して中枢へと伝える。この視細胞は桿体細胞(retinal rod)、錐体細胞(retinal cone)にわけられる。暗所では暗電流(dark current)と呼ばれる内向き電流が流れることによって脱分極した状態にある。これは、外節部分の細胞膜のサイクリックヌクレオチド依存性イオンチャネル(CNG channel)を通ってNa+、K+イオンが流入するためである。明所では視細胞外節のロドプシンが異性化することによって、Gタンパク質であるトランスデューシンを活性化し、ホスホジエステラーゼ(PDE)が活性化する。このPDEによって細胞内のcGMPが加水分解されるため、細胞内のcGMP濃度が減少する。これによってCNG channelが閉じ、過分極することで発生した電気信号が視神経に伝達される。 この光応答でのトランスダクションの過程は電気生理学などによって多く研究されている。Ca2+イオンはこの過程でcGMPの産生に必要なグアニル酸シクラーゼ(GC)やロドプシンキナーゼ(RK)を抑制することが知られている。明所ではcGMP濃度は減少するが、同時にCNG channelからのCa2+イオン流入が減少するためフィードバックによってcGMPの産生が増える。このようなCa2+を介した調節機構が明順応の原因となっている。 パッチクランプ法は、膜を通るイオン電流を記録することによってイオンチャネルの活動を解析する方法である。本研究ではパッチクランプ法の中のひとつである、excised patchを用いてCNG channelの性質を解析した。 材料と方法材料にはウシガエル(Rana catesbeiana)を用いた。ウシガエルを脊髄破壊によって不動化した後、眼球を摘出した。さらに眼球から網膜を単離し、シルガードでコートしたディッシュ上で細かくチョップすることにより単離桿体標本を作製した。遊離した視細胞で外節のみとなったものを生理的塩類溶液(*溶液1)、または二価の陽イオンを取り除いた生理的塩類溶液(*溶液2)に浸し顕微鏡下にセットした。パッチ電極はMicropipette Puller(Sutter Instrument、P-97/IVF)を用いて作成した。電極内溶液には細胞を浸した溶液とそれぞれ同じ溶液を用いた。記録した電流はパッチクランプ増幅器(Axon Instruments、Axopatch 1D)で増幅し、コンピュータに取り込んだ。保持電位は-80mVに固定した。記録を開始する前に電極の抵抗値が5〜15MΩであることを確認した。次に電極を視細胞外節に対して垂直方向に接触させ、抵抗値が1GΩ以上になるように電極内の圧力を下げギガシールを形成した。これをゆっくりと電極を引き上げることによって細胞から膜のパッチを切り取りinside-out patch標本を得た。cGMP(5mM)を加えた溶液を滴下し、膜の電流の変化を計測した。
*溶液1 Glucose 10mM、NaCl 140mM、KCl 5mM、sodium HEPES 10mM、CaCl2 2mM、MgCl2 1mM 結果と考察細胞膜を-80mVに電位を固定した状態でcGMPを加えると、図1に示すような過分極の応答がみられた。抵抗値が1GΩをこえるギガシール状態を形成すると、膜を介した電流によってチャネルの活動を記録することができる。また、この電極を引き上げinside-out modeにすると細胞内の因子の影響を検証することができる。そのため細胞内に存在するCa2+を取り除くことで、コンダクタンスの大きな変化を記録することができる。しかし、イオン条件の変化は細胞膜の劣化を早めてしまうため、ギガシール形成の成功率をあげることが課題であった。 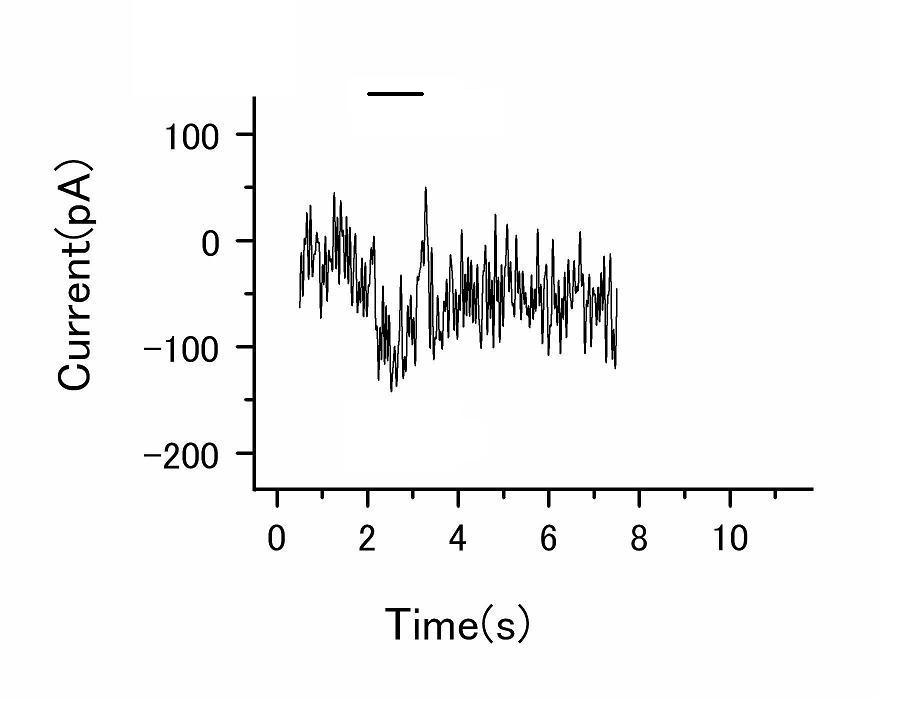
図1 cGMP5mMを投与したのときの応答
©2006 筑波大学生物学類
|