|
つくば生物ジャーナル Tsukuba Journal of Biology (2006) 5: TJB200601200200754
テトラヒメナの新規ミオシンMyo13の機能解析
杉田 真希 (筑波大学 生物学類 4年) 指導教員:沼田 治 (筑波大学 生命環境科学研究科)
【目的】
ミオシンは、アクチン繊維上を移動する分子モーターであり、その機能とアミノ酸配列の特徴から19のクラスに分類されている。各クラスのミオシンは、筋肉や収縮環における収縮力の発生、小胞の輸送、アクチン細胞骨格の細胞膜へのアンカリングなど多様な生命現象を担っている。さらに、動物細胞の細胞質分裂は収縮環の収縮によってなされており、その収縮にはフィラメントを形成するclassⅡミオシンの働きが必須である。
テトラヒメナは、細胞前方にある口部装置から物質を食胞に取込み、内容物を消化しながら輸送し、細胞後方にある細胞肛門から未消化物を排出する。食作用は、テトラヒメナなどの単細胞生物における栄養源獲得の手段であるだけではなく、高等動物の発生や免疫機構に不可欠な現象である。また、テトラヒメナは、動物細胞と同様な細胞質分裂をするため、収縮環形成を研究するのに良いモデル生物である。
最近、Tetrahymena thermophilaの全ゲノム配列が解読され、全部で13種類のミオシンをコードするORFが同定された。アミノ酸配列を系統的に比較した結果、テトラヒメナのミオシンは既存のクラスに属さないことがわかった(岩滝ら、未発表結果)。テトラヒメナのミオシンは、独自のクラスターclassXXを構成するMyo1~12と、それらと独立した所属不明のMyo13からなる。個々のミオシンの細胞内機能は、C末端にある機能ドメインによって特徴付けられる。Myo13のC末端側は、特徴的な長いコイルドコイル配列を持つことから、多量体を形成し、フィラメントとして働く可能性が高い。したがって、テトラヒメナのMyo13は、classⅡミオシンと相同の機能を担うことが期待された。そこで、私はテトラヒメナのMyo13の機能を調べた。
【方法】
1. MYO13遺伝子のクローニング
T. thermophilaのcDNA ライブラリーから、MYO13を PCR 法により増幅し、クローニングした。得られたDNA 断片については塩基配列を調べて、目的の遺伝子であることを確認した。
2. 大腸菌を用いたMyo13の部分配列の発現とそれに対する抗体の作製
pGEX4T-1 を用いてMYO13の cDNA の一部(862~927a.a.)を発現させた。テトラヒメナにおいてGln をコードするTAA とTAGは、一般的な生物では終止コドンとなる。そのため、特異的なプライマーを用いて、それら(869、880、907、909、914、918、923a.a.)をCAAとCAGに改変した。この遺伝子を発現した大腸菌を破砕し、得られた抽出液からグルタチオンビーズに結合するタンパク質を回収した。SDS-ポリアクリルアミドゲル電気泳動でGST-Myo13断片(862~927a.a.)を分離し、アジュバンドと混合したエマルジョンをウサギの皮下に注射した。免疫したウサギの血清をアフィニティー精製し、実験に用いた。
3. 間接蛍光抗体法によるテトラヒメナの免疫染色
テトラヒメナを遠心分離した後、100%メタノールで固定した。細胞を、ポリL-リジンでコートしたスライドガラス上に付着させ、0.2% TritonX-100で処理した。抗Myo13抗体(200倍希釈)を加え、室温で5時間反応させた。洗浄後、蛍光標識抗ウサギIgG抗体(100倍希釈)を加え、室温で2時間反応させた。余分な抗体を洗浄により除去した後、共焦点レーザー顕微鏡で観察した。
【結果・考察】
cDNAの塩基配列から、Myo13は全長1357a.a.で、予想分子量156kDaであることがわかった。C末端側の機能ドメインは、ほとんどがコイルドコイルを形成することが予想された。一方、これまでの実験では、分裂時のテトラヒメナの分裂溝にはMyo13の局在は確認されていない。しかし、細胞質分裂にMyo13が関与する可能性は否定できない。
抗Myo13抗体を用いた、テトラヒメナのライセートに対するウェスタンブロッティングの結果、約200kの主要なバンドが検出された。このバンドは、Myo13の予想分子量である156kDaより大きかった。しかし、GST-Myo13断片(862~927a.a.)により抗Myo13抗体を吸収した吸収抗体を用いてウェスタンブロッティングを行なった結果、200kのバンドは検出されなかった。そのため、Myo13に対して特異的な抗体が調製できたと判断した。Myo13は電気泳動の移動が遅いタンパク質なのかもしれない。
抗Myo13抗体を用いた免疫染色を試みた。その結果Myo13は、口部装置、ディープファイバー、細胞肛門、そして一部の食胞に局在することが認められた。Myo13とアクチンの二重染色を行なった結果、口部装置とディープファイバー、食胞においてはそれらの共局在性が認められた。一方、細胞肛門では、細胞肛門全体にMyo13とアクチンが共局在していたが、細胞肛門の陥入部の周辺はMyo13がリング状に強く局在し、アクチンは局在していなかった。アクチン脱重合剤であるラトランキュリンBで細胞を処理すると、口部装置、ディープファイバー及び食胞におけるMyo13の局在は消失した。一方、細胞肛門の陥入部周辺のMyo13はリング状に局在し続けた。さらに、Myo13のリングの形状から、これらの細胞の細胞肛門は開口された状態であることが示された。以上の結果から、口部装置とディープファイバーにおいて、Myo13はアクチンと相互作用して食胞を形成し、細胞肛門では、食胞の排出を促していることが考えられた。細胞肛門陥入部周辺のMyo13のリング状構造は、食胞排出時に開閉される分子装置である可能性が高い。このような構造は、新しい知見だと思われる。
今後は、アンチセンス rRNA 法を用いてMYO13をノックダウンし、その機能について調べる予定である。
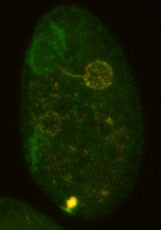 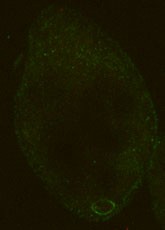
fig.1 テトラヒメナのMyo13とアクチンの二重染色像 fig.2 ラトランキュリンB処理によって細胞肛門が開口した細胞
©2006 筑波大学生物学類
|