|
つくば生物ジャーナル Tsukuba Journal of Biology (2006) 5: TJB200601200200794
イモリ桿体視細胞における光応答の電気生理学的解析
山口 陽子 (筑波大学 生物学類 4年) 指導教員:中谷 敬 (筑波大学 生命環境科学研究科)
【導入】
脊椎動物の網膜は何種類もの異なる細胞が層状に重なり合うことで構成されているが、中でも光刺激を電気信号に変換して伝達する錐体細胞及び桿体細胞の機能は、これまで多くの人々の関心を引いてきた。これらの一次ニューロンは光を受容すると過分極応答をするという性質を持っている。近年、分子生物学的手法をはじめとする実験技術の進歩に伴い、こうした応答を引き起こす視物質の特性や細胞内トランスダクションに関する研究は目覚しい発展を遂げた。一方で、細胞に流れる膜電流を直接記録する電気生理学的手法は古典的なものになりつつある。しかし、実際に生きた細胞からその応答の全容を記録できるという点において(それは即ち細胞内で起こる無数の現象を統合した結果を観察することであるわけだが)、依然その重要性は高い。
一般にこうした視覚メカニズムの研究ではポピュラーな材料として両生類のカエルやイモリが用いられ、このうちイモリは網膜再生に関する研究においても積極的に使用されているが、意外にもその視細胞単位での光応答を電気的に記録した例はない。
これを踏まえ、本研究ではイモリ桿体細胞の光応答を電気生理学的手法により記録し、その特性を明らかにすることを目的とした。
【材料・方法】
材料には動物業者から購入したアカハライモリ(Cynops pyrrhogaster)を用いた。一晩暗条件に置いたイモリを断頭した後、弱赤色光下で両眼を摘出し、さらに赤外線イメージコンバータと顕微鏡を用いて網膜を摘出した。次に摘出した網膜一枚を二等分し、得られた網膜片1/2枚を剃刀で細かくチョップした。これを顕微鏡ステージ上のチャンバーに移した後、CCDカメラを通して適当な細胞を探し、吸引電極法による光応答記録を試みた。刺激として用いた光の波長は500nmであり、刺激時間は20ミリ秒である。なお、実験中はチャンバーにイモリのRinger溶液を還流した。溶液は実験を通して室温に保たれた。そのpHは7.6であり、組成は以下の通りである(単位はmM):NaCl 110、KCl 2.5、CaCl2 1.0、MgCl2 1.6、Na-HEPES 5.0、D-Glucose 5.0。
以上、イモリの解剖から実際の細胞応答記録に至るこの一連の過程は、全て暗室内で行われた。
*吸引電極法
……ガラス製のマイクロピペットで細胞(今回は桿体細胞の外節)を吸引し、ピペット内に挿入した電極で細胞に流れる電流を記録する手法(写真参照)。
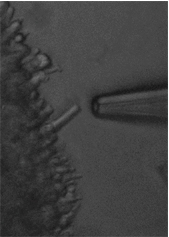
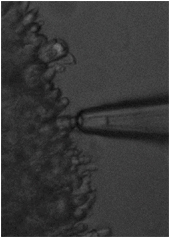
写真:吸引電極法
左は吸引前、右は吸引後。
【結果】
イモリ桿体細胞に光刺激を与えると、内向き電流が観察された。この応答の大きさは刺激光の強度に依存して増大し、その値は他の脊椎動物の桿体細胞と同様に、Michaelis方程式から導き出される値によく合致した。
現在のところ、観察されたrmax(各細胞における最大応答値)の中で最大のものは約37pAであり、i0(half-saturating intensity:各細胞において応答が最大値の半分になる際の光強度)は平均して約0.15photons・μm-2であるが、詳細についてはなお解析中である。
以下に応答の一例を示す。この細胞におけるrmaxは約12pAであり、i0は0.17photons・μm-2であった。
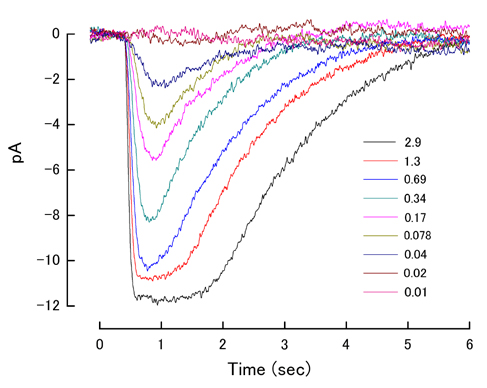
図:イモリ桿体細胞の光応答
横軸の時間は刺激時を0とする。各線はそれぞれ9〜25sweepを平均化したもの。凡例は刺激光の強度(1フラッシュあたりの光子数、単位はphotons・μm-2)。信号は20Hzのlow-passフィルターを介して記録された。
©2006 筑波大学生物学類
|