|
つくば生物ジャーナル Tsukuba Journal of Biology (2007) 6: TJB200701200310741
黄色ブドウ球菌の薬剤応答タンパク質,Drp35の活性中心の探索
大木 優 (筑波大学 生物学類 4年) 指導教員:太田 敏子 (筑波大学 人間総合科学研究科)
「研究背景と目的」
黄色ブドウ球菌は、ヒトの表皮・鼻粘膜に常在するグラム陽性細菌であり、様々な抗生物質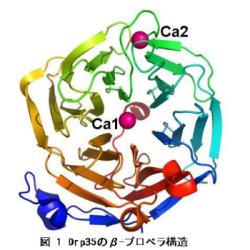 に対する耐性を容易に獲得することから、
近年、院内感染症の原因菌として社会問題となっている。黄色ブドウ球菌は、
細胞壁合成を阻害する抗生物質および界面活性剤にさらされることにより分子量約35kD
aのタンパク質(a 35kDa Drug Responsible Protein; Drp35)を過剰発現すること
が知られている。これまでの研究から、Drp35はCa2+依存的なla
ctonase活性を有し、dihydrocoumarin(DHC) , 2-co
umaranone を加水分解することが明らかになっている。また、X線結晶構
造解析の結果、Drp35と同様にCa2+依存性のlactonase活性を有する真核生
物由来のparaoxonase(PONs)やLoligo vulgaris由来のdiisopropylfluorophosphatase (DFPase)と共通のβ-プロペラ構造を有していることが明らかになっている(図1)。本研究では、一次構造および立体構造情報をもとに種々の変異タンパク白質を調製し、それらのlactonase活性の解析から、Drp35の活性部位や活性残基の決定、およびDrp35のlactonase活性発現メカニズムを提唱することを目的とした。 に対する耐性を容易に獲得することから、
近年、院内感染症の原因菌として社会問題となっている。黄色ブドウ球菌は、
細胞壁合成を阻害する抗生物質および界面活性剤にさらされることにより分子量約35kD
aのタンパク質(a 35kDa Drug Responsible Protein; Drp35)を過剰発現すること
が知られている。これまでの研究から、Drp35はCa2+依存的なla
ctonase活性を有し、dihydrocoumarin(DHC) , 2-co
umaranone を加水分解することが明らかになっている。また、X線結晶構
造解析の結果、Drp35と同様にCa2+依存性のlactonase活性を有する真核生
物由来のparaoxonase(PONs)やLoligo vulgaris由来のdiisopropylfluorophosphatase (DFPase)と共通のβ-プロペラ構造を有していることが明らかになっている(図1)。本研究では、一次構造および立体構造情報をもとに種々の変異タンパク白質を調製し、それらのlactonase活性の解析から、Drp35の活性部位や活性残基の決定、およびDrp35のlactonase活性発現メカニズムを提唱することを目的とした。
「実験」
・変異体Drp35の活性測定
DHCの分解活性は、分光光度計(U-3000 spectrophotometer, Hitachi)を用いて、280nmの吸光度の変化から評価した。
・野生型Drp35の最適pHの決定
活性残基についての知見を得るために、野生型Drp35のDHC分解活性をpH 4.1~pH 9.0 の範囲で測定した。pH 4.1~ 5.5では酢酸ナトリウムbuffer、pH 5.6~ 6.8 ではMES buffer、pH 7.4~ 9.0ではTris- HCl bufferを使用した。
「結果と考察」
立体構造を比較した結果、Drp35にはPONsやDFPaseの活性残基は保存されていなかった。そこで、他の微生物(S. epidermidis, B. japonicum
, Acinetobacter sp., B. bronchiseptica, X. fastidiosa, Z. mobilis)
由来のDrp35との配列アライメントにおいて完全に保存されている22種類のアミノ酸残基 (P22, E48, G4
9, F52, G56, L58, D62, C98, D139, F142, G146, Y149, D152, P160, G162,
N204, R208, L211, D236, G252, V256, T283) に着目した。これらの残基のアラニン変異体を調製し、DHCの分解活性を野生型Drp
35と比較した結果、中心溝のCa2+周辺に位置する残基の変異体で急激に活性が減少したことから、D
rp35の活性部位はCa結合部位周辺であることが明らかになった。そこで、Ca2+の付近に存在する残基に着目し、これらの残基のアラニン置換体の解析を行った。変異導入部位は
、1)Ca2+に直接結合している残基(E48, D138, N185, D236, S237)、2)中心溝の入り口付近の残基(Q46, F64, F108, F153, H232, E233, Y251, R281, E302)、3)Ca2+の後部に位置する残基(K93, C238, H284) であるが、
S237Aを除くCa2+結合残基への変異導入によりlactonase活性が著しく減少したことから、
Ca結合残基が特に重要であると考えた。Ca2+結合残基について更なる解析を行うため、
E48S, E48Q, D138S, D138N, N185S, N185D, D236S, D236N変異体を調製し、
その活性を測定したところ、変異体N185D, S237Aでは十分に活性が維持されていた。
従って、これらの残基はlactonase活性に強く関与していないと考えられ、
活性残基はE48, D138, D236に絞られた。示差走査熱量測定の結果、
D138Nは野生型と同程度のCa2+結合能を有するが、E48Q,
D236NはCa2+との結合活性が著しく低いことが示され、
E48、D236の変異体の失活の原因はCaが結合していないことに起因し、
従ってD138が活性残基として重要であると考えた。
D138についての知見を得るためにD138N変異体のX線結晶構造解析を行ったが、
D138NがCa2+と結合し、野生型と同様な立体構造を維持している一方で、
D138に配位していた水分子が欠失していた。こられの結果を考え合わせ、
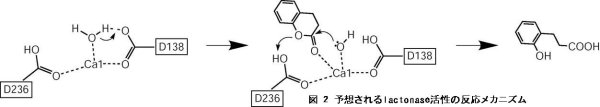
Drp35において、lactonase活性に直接関与している残基はD138であり、
D138が配位する水を活性化し、DHCの加水分解が起こるという反応メカニズムが提案された(図2)。
pH依存性の測定からは、反応のpKaが5.4と6.7であることが明らかになったが、
酸性側のpKa(5.4)はカルボキシル基が直接関与する、上述の反応メカニズムを強く裏付ける。
©2007 筑波大学生物学類
|
 に対する耐性を容易に獲得することから、
近年、院内感染症の原因菌として社会問題となっている。黄色ブドウ球菌は、
細胞壁合成を阻害する抗生物質および界面活性剤にさらされることにより分子量約35kD
aのタンパク質(a 35kDa Drug Responsible Protein; Drp35)を過剰発現すること
が知られている。これまでの研究から、Drp35はCa2+依存的なla
ctonase活性を有し、dihydrocoumarin(DHC) , 2-co
umaranone を加水分解することが明らかになっている。また、X線結晶構
造解析の結果、Drp35と同様にCa2+依存性のlactonase活性を有する真核生
物由来のparaoxonase(PONs)やLoligo vulgaris由来のdiisopropylfluorophosphatase (DFPase)と共通のβ-プロペラ構造を有していることが明らかになっている(図1)。本研究では、一次構造および立体構造情報をもとに種々の変異タンパク白質を調製し、それらのlactonase活性の解析から、Drp35の活性部位や活性残基の決定、およびDrp35のlactonase活性発現メカニズムを提唱することを目的とした。
に対する耐性を容易に獲得することから、
近年、院内感染症の原因菌として社会問題となっている。黄色ブドウ球菌は、
細胞壁合成を阻害する抗生物質および界面活性剤にさらされることにより分子量約35kD
aのタンパク質(a 35kDa Drug Responsible Protein; Drp35)を過剰発現すること
が知られている。これまでの研究から、Drp35はCa2+依存的なla
ctonase活性を有し、dihydrocoumarin(DHC) , 2-co
umaranone を加水分解することが明らかになっている。また、X線結晶構
造解析の結果、Drp35と同様にCa2+依存性のlactonase活性を有する真核生
物由来のparaoxonase(PONs)やLoligo vulgaris由来のdiisopropylfluorophosphatase (DFPase)と共通のβ-プロペラ構造を有していることが明らかになっている(図1)。本研究では、一次構造および立体構造情報をもとに種々の変異タンパク白質を調製し、それらのlactonase活性の解析から、Drp35の活性部位や活性残基の決定、およびDrp35のlactonase活性発現メカニズムを提唱することを目的とした。