|
つくば生物ジャーナル Tsukuba Journal of Biology (2007) 6: TJB200701200310746
クラミドモナスの鞭毛にあるイオンチャネルの解析
太田 萌 (筑波大学 生物学類 4年) 指導教員:吉村 建二郎 (筑波大学 生命環境科学研究科)
【背景・目的】
鞭毛や繊毛による運動については長く研究が行われており、細胞膜の興奮によって起きる脱分極をきっかけにCa2+が流入することが運動の制御に必要であることが知られている。クラミドモナスは二本の鞭毛を持つ単細胞生物で、光合成の際に必要な光の方向へ向かう走光性や、光強度の急な変化から回避する光驚動反応を示す。光を受容すると眼点で光受容性電流が起こり、細胞内が脱分極して、鞭毛にある電位依存性カルシウムイオンチャネルが開いて鞭毛電流が発生する。このように細胞レベルでの研究は進んでいるにも関わらず、分子レベルでの生理学的なアプローチは少なく、実際にどのようなイオンチャネルが働いているかは明らかではない。その原因の一つは鞭毛が細いためパッチクランプが困難である点にある。そこで、本研究ではクラミドモナスの鞭毛からチャネルタンパク質を可溶化し人工膜に再構成することにより、その電気生理学的な性質を調べた。 【材料と方法】
1. クラミドモナスの鞭毛にある膜タンパク質の調整
クラミドモナスの野生型の細胞をTAP培地で3-4日間液体培養した後、pH shock法による脱鞭毛を行った。遠心によって細胞体を取り除き、鞭毛の含まれる画分に界面活性剤オクチルグルコシドを加えた。遠心により軸糸を除去し、可溶化された鞭毛の膜タンパク質を得た。
2. Azolectinの可溶化
Azolectinは、リポソームを作製し、精製した膜タンパク質を組み込んで性質を調べる再構成膜の実験などによく用いられる。Azolectinをクロロホルムに溶解し、窒素ガスでガラス管の壁面にフィルム状に乾燥させた。これにバッファーを加えてよく溶かした。
3. タンパク質のリポソームへの組み込み
鞭毛の膜タンパク質を可溶化したAzolectinに加え、1日間透析してオクチルグルコシドを除いた。超遠心してリポソームを回収し、dehydration/rehydration処理を行った。
4. パッチクランプ法による単一チャネルの電流測定
再構成膜を、バッファー(200 mM TEA, 90 mM MgCl2, 1 mM BaCl2, 5 mM Tris-HCl pH6.0)を満たしたトロフ付きのチャンバーの底面に塗り、10-60分くらい待つとブリスターと呼ばれる一枚の脂質二重膜が形成した。このブリスターの一部をガラス電極で吸引してパッチを切り出した。-100 mVから+100 mVのステップ状の電位を膜に与え、チャネル電流を測定した。
5. チャネル電流の解析
測定された電流の大きさを縦軸に、かけた電位差を横軸にとって膜電位とチャネル電流の大きさとの関係をグラフにし、一次式に近似してその傾きからコンダクタンスを求めた。
【結果・考察】
鞭毛の膜タンパク質を再構成したパッチ膜に、-100 mVから+100 mVにかけて20 mVごとのステップ状に電位差を与えたとき、パッチごとにイオンチャネルが数種類測定できた。図1にその一例を示した。このチャネルは370 pSのコンダクタンスをもち、電位依存的に不活性化が起こりやすくなった。例数を増やしたが、多種のイオンチャネルが存在して、グループ分けはまだできていない。
今回の実験ではカリウムチャネルを測定しないようにK+を除き、さらにCa2+によるチャネルの不活性化を防ぐためにCa2+をBa2+に置き換えてある。したがって、溶液に含まれる無機イオンはBa2+, Cl-, Mg2+のみであり、測定されたチャネルはこの中のいずれかを通すチャネルであると考えられる。カルシウムチャネルはBa2+をも通すことが分かっているので、この中に鞭毛運動に関与するカルシウムチャネルが含まれている可能性が高い。今後は、ブリスター形成に必要であったMg2+を除いた溶液に交換したり、Cl-チャネルのブロッカーを用いてBa2+電流のみを測定するなどして、鞭毛にあるイオンチャネルの一覧を作成したい。
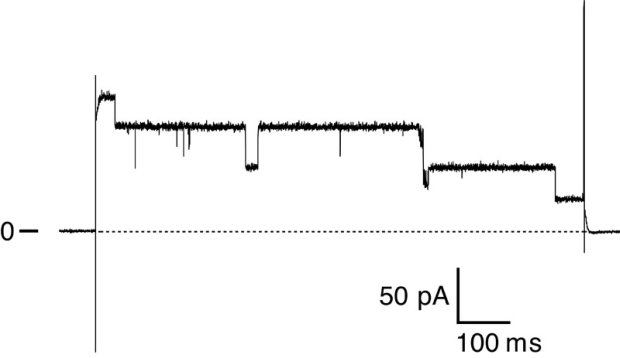
図1. 膜に+100 mVの電位を与えたときに測定された電流
©2007 筑波大学生物学類
|
