|
つくば生物ジャーナル Tsukuba Journal of Biology (2007) 6: TJB200701200310787
p53によるフォークヘッド型転写因子FOXOの機能制御機構の解析
土谷 恵太 (筑波大学 生物学類 4年) 指導教員:坂本 和一 (筑波大学 生命環境科学研究科)
【背景・目的】
FOXO(FKHR)はフォークヘッド型のDNA結合ドメインを持つ転写因子で、主にインスリンシグナル経路によって制御される。現在までに、FOXOサブファミリーにはFOXO1,FOXO3a,FOXO4,FOXO6の4つが知られており、その機能は細胞周期やアポトーシスの制御、DNA修復、酸化ストレスに対する防御など多岐にわたる。これまでの報告により、細胞内においてFOXOはp53と結合して機能的にも相互に作用し合うことが示唆されているが、その詳しい分子機構についてはほとんど明らかにされていない。
そこで本研究では、FOXOとp53が細胞内でどのように関わり合い、相互の転写因子活性を制御し、細胞の生存・アポトーシス等の生理作用に関与するのか、それらの分子メカニズムを明らかにすることを目的とした。
【材料・方法】
実験には、COS7細胞(サルの腎臓由来)を用いた。また、トランスフェクションにはリポフェクション法(lipofectamine2000,invitrogen)を用いた。
1.ルシフェラーゼアッセイ
リポフェクション法を用いて、β-ガラクトシダーゼ発現ベクターと共にFOXOまたはp53の発現ベクターをCOS7細胞に導入した。レポーターにはルシフェラーゼ遺伝子(Luc)の上流に、FOXOまたはp53の標的配列を組み込んだIRS-Lucやp53RE-Lucの各プラスミドDNAを用いた。遺伝子導入48h後にルシフェラーゼアッセイを行い、FOXOとp53の転写因子活性を測定した。さらに細胞回収の1hまたは3h前にH2O2(100μM,250μM,500μM,1mM)を添加し、酸化ストレスによる転写因子活性への影響も調べた。また、βガラクトシダーゼアッセイにより、総タンパク量の補正を行った。
2.免疫沈降法
HAまたはFlagタグで標識したFOXO-HAまたはp53-Flag各プラスミドDNAをCOS7細胞に導入した。遺伝子導入後の細胞を48h培養し、細胞抽出液を得た後、HA抗体で免疫沈降を行った。免疫沈降により得られたタンパク質をSDS-ポリアクリルアミド電気泳動(SDS-PAGE)法で分離し、ウエスタンブロット法により検出した。
【結果と考察】
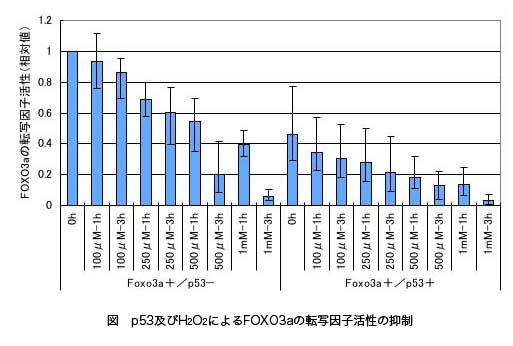
ルシフェラーゼアッセイによりFOXO3aの転写因子活性を調べたところ、p53を共発現させた場合には、p53を導入しない場合に比べ転写因子活性が30〜40%程度にまで減少した(図)。一方、FOXO1の転写因子活性ではp53の有無による変化はみられなかった。また、p53の転写因子活性はFOXO1、FOXO3aの有無に関わらず一定であった。また、酸化ストレス下ではそのH2O2の強度と時間に応じてFOXO、p53ともに転写因子活性が減少した(図)。特に、高濃度(500μM,1mM)のH2O2で長時間(3h)処理した場合、転写活性の著しい減少が認められた。一方、p53によるFOXO3aの抑制に対する酸化ストレスの影響は見られなかった。これらの事実から、p53によりFOXO3aは抑制的に支配されているがFOXO1はその支配を受けていないこと、さらにFOXOはp53の機能に影響を与えないことが分かった。酸化ストレスはFOXO及びp53の転写因子活性を抑制し、その抑制機構は酸化ストレスの程度の違いにより異なることが示唆された。
また、免疫沈降法を用いた解析により、FOXO3aとp53とは細胞内で結合しており、その結合は酸化ストレスの有無に影響されないことが明らかになった。
【今後の課題】
p53によるFOXOの抑制が実際にどの段階で起きているのか明らかにしていきたい。そのため、EMSAを用いてDNA結合能の変化が起きているのか、またウェスタンブロット法等によりタンパク質の局在変化が起きているのかを調べていく。さらに、p53による抑制が実際の生理機能にどのように関わるのか、RT-PCR法を用いてFOXOの下流遺伝子の発現変化を調べることで明らかにする必要がある。
©2007 筑波大学生物学類
|