|
つくば生物ジャーナル Tsukuba Journal of Biology (2005) 4: TJB200506YS.
特集:下田臨海実験センター
遺伝学的アプローチによる脊索動物ホヤの発生機構の解明笹倉 靖徳(筑波大学 生命環境科学研究科 下田臨海実験センター)
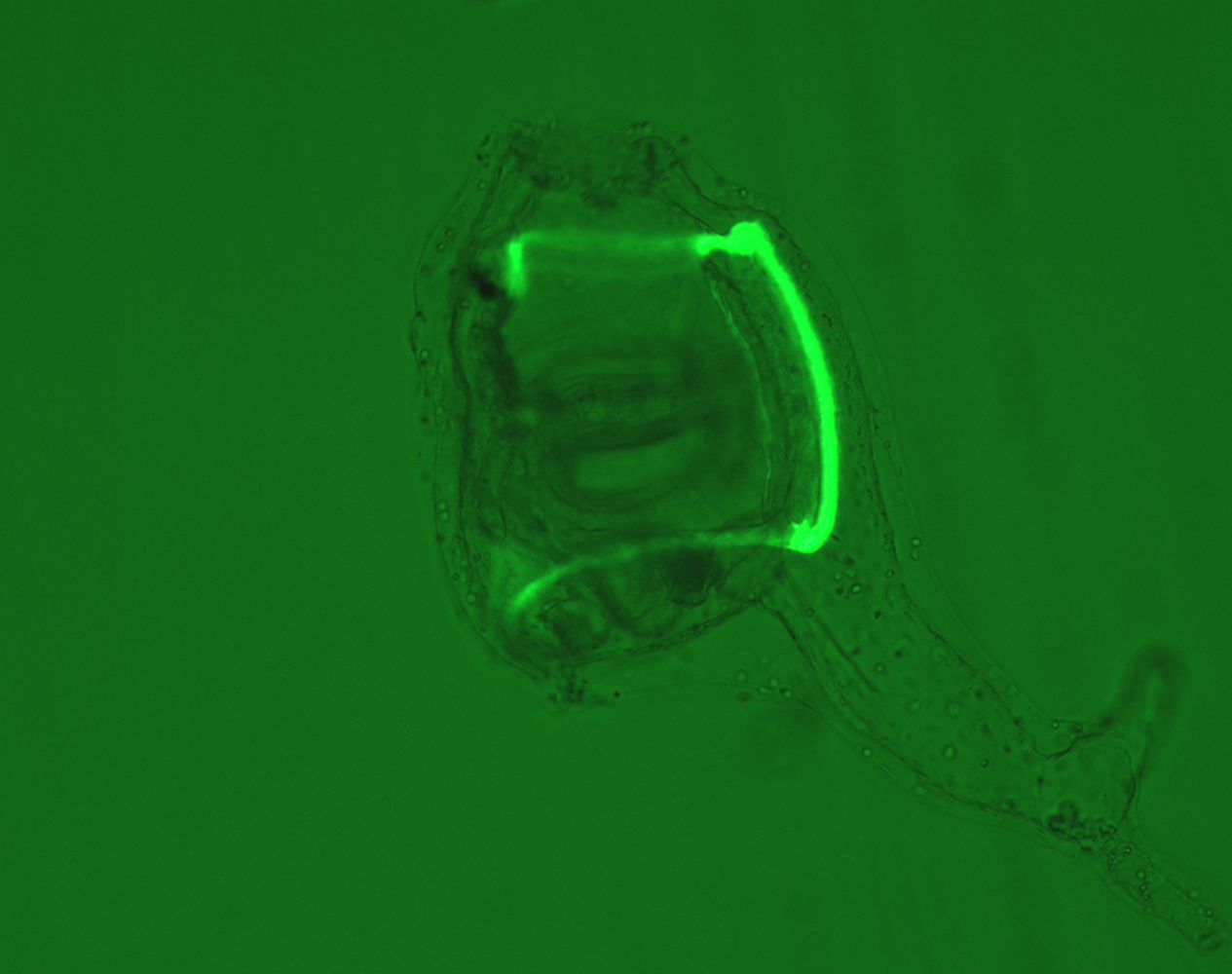
生殖分子情報学研究室・笹倉研は今年2005年の4月に下田臨海実験センターにできたばかりの新しいグループです。我々のグループでは、海産無脊椎動物のホヤの一種、カタユウレイボヤCiona intestinalisを用いて、このホヤの発生プロセスにおける遺伝子機能を、遺伝学を用いたアプローチ、つまり突然変異体を単離し解析することを通じて解明することを主眼に研究を進めています。 皆さん、発生学のモデル生物としてどのような生物が頭に浮かぶでしょうか。動物ではキイロショウジョウバエ、線虫、ゼブラフィッシュ、マウス、植物ではシロイヌナズナあたりでしょうか。これらは全世界で精力的に研究が進められている生物ですが、これらが「モデル生物」として広く認識されている大きな要因として「遺伝学を用いた遺伝子機能解析」ができることにあります。特にキイロショウジョウバエのものは有名で、この生物から様々な遺伝学的テクニックが開発されていきました。これらのモデル生物の顔ぶれを見たときに、発生学の教科書に出てくるような多くの動物(門)が抜けていることに気づくでしょう。特に海産の無脊椎動物においては、遺伝学的な手法が導入されている例はほぼ皆無といってよい状況なのです。その理由として、飼育の難しさや世代時間の長さが挙げられます。しかしながらそれらの生物の系統学的立場や独特な発生現象を鑑みれば、それらの発生機構における遺伝子機能を調べることから様々な興味深い知見が得られることは明白ですし、遺伝子機能解析としてはやはり遺伝学を用いるのが最も効果的です。 実際、我々が使っているカタユウレイボヤは遺伝学に適した研究材料です。それはホヤが脊椎動物と姉妹群の脊索動物であるという系統学的に重要な位置に属する生物であることに加えて、世代時間が2−3ヶ月と短いことや室内完全閉鎖系での飼育が可能であることが理由として挙げられます。そしてなによりも、カタユウレイボヤのゲノムの塩基配列が2002年に公開されたということが大きな理由です[1]。このゲノムプロジェクトから得られたデーターを基にして、カタユウレイボヤの持つほとんどの遺伝子が明らかとなりました。このホヤの遺伝子総数はおよそ15,852個と、キイロショウジョウバエの遺伝子数とほとんど変わらない数値であり、またモデル脊椎動物の半分以下しかないことが判明しました。解析対象の遺伝子が少なく、ゲノム中に高密度に存在していることから、発生遺伝学においてよく利用される手法である突然変異体の単離が比較的容易にできる可能性がある事を示唆していました。当時ポスドクだった私は、このカタユウレイボヤを、遺伝学のテクニックが利用可能な世界初の海産無脊椎動物にすることを研究テーマに選びました。 カタユウレイボヤの室内飼育の系を立ち上げた私と共同研究者のグループは、続いて突然変異体を作製するために必要な技術をこのホヤに導入することに着手しました。突然変異体を得るためには様々な手法があり、そのうちのどの手法がホヤに適当かどうかを判断しなくてはなりませんでした。当時既に海外の研究グループでは化学変異原ENUを用いた突然変異体の作製がカタユウレイボヤ等で報告されていました。しかしながらENUは、主にDNAの塩基置換を引き起こす点突然変異の誘発因子であることが欠点でした。カタユウレイボヤには純系がなく、野生集団のゲノム配列には非常に高頻度の多型、つまり個体間での塩基配列の違いが認められます。ですからそれら多型と突然変異を明確に区別するために、突然変異として目立つものを導入しなくてはなりません。そこで我々はトランスポゾンをゲノムに挿入させることにより変異体を作製するというアプローチをとることにしました。このことには当時ホヤではゲノムにDNAを挿入させ、外来DNAを安定的に次世代に伝えさせるトランスジェニックラインの作製技術がまだ無かったため、その技術の導入をねらう目的もありました。 幸いなことに、トランスポゾンの一種Minosがホヤにおいて強い活性を有していることを突き止め[2]、このトランスポゾンをゲノムに挿入させ、その外来DNAを安定的に子孫に伝えるトランスジェニックラインの作製に成功しました[3]。そのときにトランスポゾンの目印として光る遺伝子GFPをホヤに導入したため、「緑に光るホヤ」を作製できました(写真)。さらにMinosを用いて「エンハンサートラップライン」の作製も可能であることを突き止めています[4]。最新の研究では、当初の目的である「挿入変異体」の作製にも成功しました。このときに単離された挿入変異体のひとつは、セルロース合成酵素をコードする遺伝子(ホヤを含めた脊索動物門尾索類は、動物ながらまるで植物のようにセルロースを合成する珍しい動物群)を破壊した変異体でした。この変異体の解析から動物のセルロース合成酵素の役割を知ることができました。これらの研究成果が示すように、Minosを用いることで遺伝学に必要な技術の多くのことが可能であることが証明されたのです。
以上の研究は私の前所属の京都大学大学院理学研究科の佐藤矩行教授の研究室でなされたものです。私はそこから筑波大学下田臨海実験センターに赴任しました。その所属変更の大きな動機として「海の生き物を海水のふんだんに使用できる場所で大量に飼育したい」ということがありました。カタユウレイボヤの飼育には大量の海水が必要です。そして変異体の単離や維持には多くの個体を飼育しなくてはなりません。つまり私が行いたい研究テーマはどこでも自由にできるようなものではなく、臨海実験所で行うのにふさわしいテーマであると考えています。 以上述べてきた研究を背景に、我々の研究室では海産無脊椎動物のカタユウレイボヤの順遺伝学や突然変異体作製という、世界でもほとんど行われていないノベルな研究テーマに取り組んでいる研究室です。具体的には、Minosを挿入させた挿入変異体を単離することはもとより、Minosを利用した様々な遺伝学的テクニックのカタユウレイボヤへの導入、Minos挿入ラインを用いた遺伝子やタンパク質の機能解析、特定の組織や器官をレポーター遺伝子でラベルしたマーカーラインの作製と解析などを行い、それらの研究を元にカタユウレイボヤを遺伝学の新たなモデル生物にすることを目指しています。そして将来的にはそれらのトランスジェニックラインを集めた「カタユウレイボヤ・トランスジェニックラインリソース」をここ下田臨海実験センターに設立し、世界のホヤ研究の一大拠点にしたいと考えています。我々の研究グループでは、研究テーマが世界を見渡してもほとんど行われていない新しいものであること(カタユウレイボヤでトランスポゾンを用いた遺伝学的研究を行っているのは現在のところ私たちの研究室だけです)、さらに研究室ができたばかりで新しいということもあり、他の一般的なモデル生物を用いている研究室では経験できないような貴重な体験ができると確信しています。新しい研究をやりたいという意欲的な方、この文章を読まれて興味を持たれた方は是非一度ホームページをごらんになったり(http://www.shimoda.tsukuba.ac.jp/~sasakura/index.html)、著者までコンタクトを取って頂けると幸いです。 参考文献
Contributed by Yasunori Sasakura, Received June 24, 2005.
©2005 筑波大学生物学類
|