生命維持に欠かせない膜タンパク質、その構造が見たい!
田辺幹雄 特任准教授 |
病原菌はその名の通り、私たちの体に病気を引き起こす「悪者」です。私たちの身体はそのような病原菌と闘わなければなりません。私たちの身体はどのように病原体を認識し、戦う準備をするのでしょう。またどのように薬を作用させればよいのでしょう。今回は、その疑問を解決すべく「タンパク質の構造」という観点から研究を行なっている、高エネルギー加速器研究機構、物質構造科学研究所の田辺幹雄(たなべみきお)特任准教授にお話を伺いました。
病原菌はどうやって認識されているの?
さて、私たちの身体はどのように病原菌を「悪者」と認識しているのでしょうか。
ここで活躍するのが免疫細胞です。免疫細胞は私たちの身体の中をパトロールしていて、体内にいる病原菌などを取り締まっています。免疫細胞の細胞膜上にはTLR(Toll-like receptor)という膜タンパク質があり、そこに結合した物質が悪者かどうかを判断しているのです。TLRに病原菌などの特殊な膜タンパク構造が結合すると、免疫システムが働き病原体が排除される仕組みになっています。悪者と認識される特殊な構造の一つに外膜タンパク質、OMP(Outer Membrane Protein)がありますが、これがどのようにTLRに認識されるのかは現在もわかっていません。しかもOMPにはTLRに悪者の証拠と判断されるものとそうでないものがあるのです。なぜ特定のOMPだけがTLRによって悪者と認識されるのでしょう。
田辺先生はその疑問を解き明かすため、病原菌の外膜上にあるタンパク質を研究しています。その中でも特に、髄膜炎菌(N.meningitidis)などのグラム陰性菌が持つ外膜タンパク質である「Porin」に着目しているそうです。PorinはTLRに認識される「悪者」の証拠の一つで、本来は病原菌の生育に必要な物質の輸送に関わっています。そのため「Porinの構造を明らかにすれば、病原菌に効率良く作用する抗生物質やワクチンの開発につなげることができます」と田辺先生は説明しています。またPorinの構造からTLRとの相互作用を解明すれば、症状を抑える薬の開発などに役立てることができるのです。
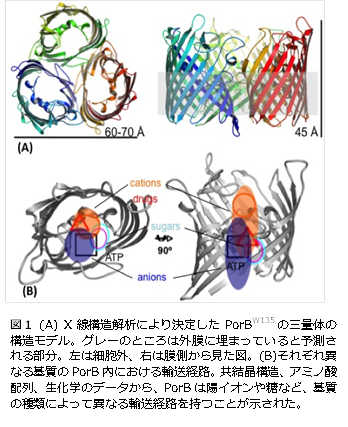
田辺先生はこれまでの研究で、このPorinの一種「PorB」の構造を、X線結晶構造解析という方法で明らかにしました。またPorBが糖やATP類などの分子と結合している場合の結晶構造も決定しました。この構造に関する情報に様々な実験の結果を合わせると、PorBはイオンや糖、抗生物質などの輸送する基質によって、異なるルートを持つことが示されたのです(図1)。
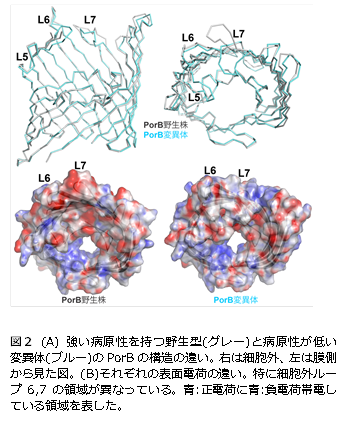
田辺先生はまた、強い病原性を持つ野生型と病原性が低い変異体のPorBを比較して構造の違いを調べました。その結果、変異体のPorBでは一部の領域が中央の孔側に折れ曲がっていて、その部分の表面の電荷も野生型とは大きく異なっていることがわかりました(図2)。このような実験から病原性に関わる領域が少しずつ明らかになってきたのです。
今後もこのように病原性に関わるさらに多くの膜タンパク質の構造を明らかにすることにより、どのように病原性に関わっているのかを研究しようとされています。
膜タンパク質の構造解析は容易ではない
PorBを含む膜タンパク質だけでなく、あらゆるタンパク質の構造を解析するためには、「X線結晶構造解析」という手法が用いられます。これは結晶化したタンパク質にX線を照射して、得られた反射像から構造を決定する方法です。「タンパク質の結晶化」と口で言うのは簡単ですが、結晶化したタンパク質を得るには結晶化試薬の組み合わせや、pH、温度など様々な条件を検討する必要があり、決して平坦な道ではありません。それに加えて、「膜タンパク質の構造解析ならではの苦労が待ちうけている」と田辺先生は話しています。
膜タンパク質は名前の通り、細胞膜上に埋め込まれているタンパク質で、その結晶化は細胞膜から出ているタンパク質の親水性領域同士を結合させて行ないます。より安定な結晶を得るためには、膜から出ている親水性の部分を多くして、タンパク質同士を結合しやすくする必要があります。
そこでまず純度の高い目的の膜タンパク質を精製するために界面活性剤が使われます。界面活性剤を使うことで細胞膜の結びつきを緩め、タンパク質を膜の外に取り出すことができます。しかし、ここで問題が二つ生じます。一つは、膜タンパク質は細胞膜から取り出すと不安定な状態になり、失活、つまりタンパク質が活性を失う可能性があること。もう一つは界面活性剤の分子の大きさの調節が難しいことです。小さな分子の界面活性剤の多くはタンパク質の構造を不安定にしてしまいます。逆に大きな分子のものを用いると、互いに結合するためのタンパク質の親水性領域が覆われてしまい、結晶化しにくくなってしまうのです。
結晶化にまつわる問題の打開
こうした問題の解決策として田辺先生が共同研究者の先生方と行なっているのが、モノクローナル抗体を用いた膜タンパク質の結晶化です。
抗体とは免疫細胞が作り出すタンパク質の一つで、特定のタンパク質を認識して結合する性質を持っています。田辺先生によると、抗体が結合することで膜タンパク質の構造が安定し、変性や失活を防ぐことができるのだそうです。またこの方法には、抗体が膜タンパク質に結合すると親水性領域が大きくなり、結晶化が促進されるという利点もあるといいます。
なお、抗体を使わない他の打開策もあり、その一つは膜タンパク質を高親和性のリガンドと結合させて取り出すという方法です。膜タンパク質の中にはリガンドと結合させた方が構造が安定化するものがあり、そのようなタンパク質の結晶化に有効な方法だといいます。
研究には、とにかくやってみる姿勢が大事
田辺先生は今年(2015年)高エネルギー研究機構に赴任するまで、大学院の博士課程からずっと海外で研究をしてきました。海外で研究をするきっかけを聞いたところ意外な答えが。なんと「膜タンパク質の構造解析の分野で一番有名な研究者たち数人にメールを送った」というのです。「返事は返ってくることもないかな?」と思っていたところ、意外なことに、イギリスにいる一人の先生から「うちの研究室に来てもいいよ」と返事がきたとのこと。かくして田辺先生は海外のラボで研究をすることになったのです。「あまり考えなしに、とにかくこの分野ですごい結果を出している人にコンタクトを取ってみた。ある意味、世間知らずで若気の至りだった」と、先生は当時を振り返ります。
その後タンパク質の構造解析を長年続けてきた田辺先生は、X線構造解析には「All or Nothing(一か八か)」なところがあると話します。質の良いタンパク質の結晶ができて綺麗な反射が出れば大きな成果が得られますが、タンパク質の種類によっては全くうまくいかないこともあるのだそうです。そんなとき先生が大事にしているのは、モットーである「とにかくやってみること」。一筋縄でいかないことも一つの楽しみだと考えて、研究に取り組んでいるそうです。かの有名なスティーブ・ジョブズの”Stay hungry. Stay foolish”という言葉があるように、ときには自分の興味に従ってとにかく行動してみることが大切なのかもしれません。
PROFILE
 田辺 幹雄(たなべ みきお) 特任准教授
田辺 幹雄(たなべ みきお) 特任准教授
大学共同利用機関法人 高エネルギー加速器研究機構 物質構造科学研究所
2002年大阪大学で修士課程を修了し、2006年にイギリスのImperial Collegeで博士課程を修了。その後、アメリカのVanderbilt University Medical Center、ドイツのUniversity of Halleでの研究生活を経て、2015年の夏に高エネルギー加速器研究機構、物質構造科学研究所の特任准教授に就任。
|
|
| 【取材・構成・文 小林 沙羅】 |
|
安達成彦先生
身体の中のナノマシン ~設計図の情報を制御する仕組み~(文・毛利 匡邦) |
千田美紀先生
タンパク質の構造を決めるまで~結晶から解析するタンパク質の構造~(文・山本 鷹之) |
鈴木喜大先生
タンパク質の構造から分子機構を解き明かす~胃がんを引き起こすピロリ菌産生物質『CagA』の正体を求めて~(文・市村 春嘉) |
湯本史明先生
複雑なタンパク質の構造を科学の力で表したい(文・沈 茹菁)
|
田辺幹雄先生
生命維持に欠かせない膜タンパク質、その構造が見たい!(文・小林 沙羅) |
|