研究の概要SERVICE&PRODUCTS
3量体型Gタンパク質の下流因子解析
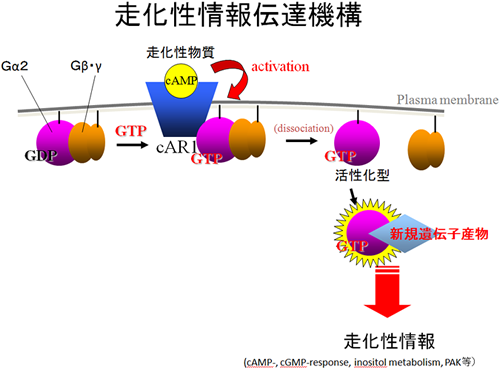
三量体型Gタンパク質はその名の通りα、β、γの3つのサブユニットからなるGTP結合タンパク質で、ヒトから酵母に至るまで高度に保存された物理 的化学的細胞外環境の変化情報を細胞内情報に変換するのに必須な重要なsignal transducerとしての役割を担っています。しかしながら、依然として直接のターゲット因子が同定とその動態の解明は進んでいません。
桑山研究室では細胞性粘菌の走化性における細胞内情報伝達をモデルとして、分子生物学、生化学、生物物理学の手法によりターゲット因子の同定とそ の動態の解明を行っています。これまでに、10以上の候補遺伝子の同定を行い、そのうち2つの遺伝子機能の解明を進めています。これらのほとんどの遺伝子
は、これまで三量体型Gタンパク質との関与が報告されていない新規遺伝子であり、今後三量体型Gタンパク質を介した細胞内情報伝達機構の新しい知見につな
がることが期待されます。
現在の研究テーマは、活性化型Gα2特異的に相互作用する遺伝子産物の機能解析です。遺伝子破壊株の作製、その表現形解析を中心に、細胞学的、生化学的な解析を行っています。
走化性情報伝達機構と3量体型タンパク質
細胞性粘菌の生活環周期を調節する新規遺伝子の機能解析
細胞性粘菌の生活環周期は一定の条件では変わることはなく、細胞分裂は約10時間、発生にかかる時間は約24時間です。本研究室において最近、細胞内小胞輸送に関わる輸送small
Gタンパク質特異的なGTPase促進因子(RabGAP)遺伝子を破壊すると生活環周期全体が短くなることを見出しました。この遺伝子の過剰発現株は、逆に生活環周期全体が長くなったことから、この新規RabGAPは細胞性粘菌の生活環周期全体を調節する機能を有することが明らかになりました。
桑山研究室ではこのRabGAP制御系の研究を分子生物学的、生化学的に行い、生活環、いわば細胞性粘菌の寿命がどのように調節されているかについて研究を進めています。
ハンチントン病病原遺伝子、ハンチンチンの細胞内情報伝達における機能解析
ハンチントン病は遺伝病であり、その原因遺伝子ハンチンチンは1993年に同定されています(Marcy E. MacDonald, et al.,
Cell, 1993)。それ以来ハンチンチン遺伝子産物に関する研究成果は非常に多く報告されています。その成果のひとつに、ハンチンチン遺伝子の第一エクソンに存在するCAGの繰り返し配列が異常に増幅された異常ハンチンチンに関する研究が挙げられます。CAGの異常増幅によりハンチンチン蛋白質のN末端付近にポリグルタミン配列の蓄積がもたらされ、これが脳内で不溶性の線維状凝集体「アミロイド」を形成することがわかりました。しかしながら、アミロイドがハンチントン病の直接の原因なのか、二次的な結果に過ぎないのかの判定は難しく、さらに、ハンチントン病によってもたらされる神経細胞の脱落、変性の疾患部位特異性とアミロイドの関係についても明らかとなっていません。現在はハンチンチン遺伝子のポリグルタミンの異常蓄積とハンチントン病発症をつなぐ具体的な分子機構の解明が重要な課題となっています。
一方、正常なハンチンチンの機能解析もハンチントン病の治療に対して重要な知見をもたらすことが期待されている。というのは、マウスにおいて正常ハンチンチンを高発現させることでハンチントン病の症状が緩和されたことから、異常ハンチンチンが正常ハンチンチンの機能を阻害しており、何らかの方法で正常ハンチンチンの機能を強化すればハンチントン病発症を抑えられることが指摘されたからです(Leavitt,
B.R. et al. Am. J. Hum. Genet. 2001)。しかしながら、正常ハンチンチンは遺伝子発現や細胞学的解析により神経関連遺伝子転写活性への関与や細胞内小胞輸送に間接的に関わっている可能性が示唆されている(Cattaneo,
E, et al., Nat Rev Neurosci, 2005)ものの、正常ハンチンチンの詳細な機能は十分に解析されているとは言えません。さらに、マウスにおけるハンチンチン遺伝子破壊は胚性致死変異であり、これが個体レベルでのハンチンチン遺伝子の機能解析を一層困難にしています。
細胞性粘菌にはハンチンチン相同遺伝子が存在し、幸いなことに細胞性粘菌のハンチンチンは遺伝子破壊により致死性を示さない(Myre et al.,
PLoS Genet, 2011)。本研究では、細胞性粘菌を用いてハンチンチンの機能解析を行います。特に、細胞内情報伝達機構での機能解析を中心として、これまで未同定である正常ハンチンチンの機能を明らかにし、ヒトでの研究に応用することを目的とします。
カフェイン耐性に関与する細胞内情報伝達機構の解明
コーヒーや緑茶などの趣向品に含まれるカフェインには疲労軽減、利尿作用、覚醒作用があることが知られています。これらカフェインの生理機能は、カフェインがアデノシン受容体に拮抗したり、ホスホジエステラーゼの活性を阻害したりすることにより細胞内でのcAMPの濃度上昇を引き起こし、結果的に心筋収縮力の増大、気管支平滑筋の弛緩、脳細動脈の収縮のような交感神経興奮様作用を引き起こすことよることがわかっています。一方、過剰のカフェインは個体にとって強い毒性を示し、過度の摂取は死をもたらすことも知られています(一般的な成人の場合カフェインの致死量は10-12
g 以上です)。
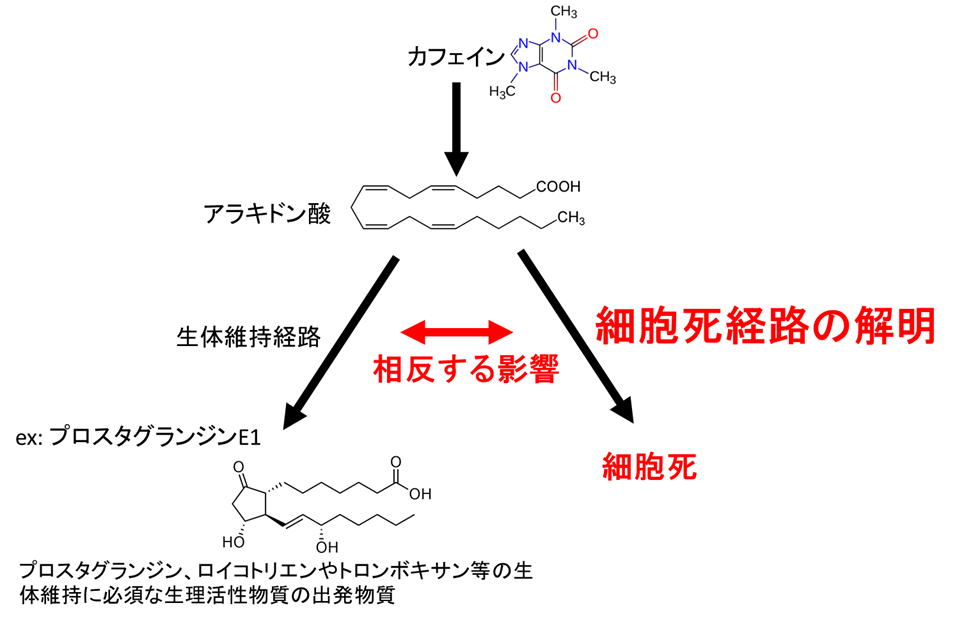
カフェインが細胞にとって毒になる分子機構はこれまで詳細に調べられておらずその全容は不明でしたが、私たち研究室では最近カフェインがアラキドン酸の遊離を促し、遊離したアラキドン酸が細胞死をもたらすという新機構を発見した(Kuwayama,
Scientific Reports, 2, 577, 2012)。注目されたのは、生体維持に必須であるはずのアラキドン酸が細胞の致死に関与していた点です(2012年8月15日付け毎日新聞掲載)。さらに、この経路が予定細胞死(apoptosis)において重要な働きをするカスパーゼ活性に非依存的に働くことも示しました。これまで細胞死にはカスパーゼ非依存的な経路があることが示唆されていますが、その経路は現在のところ不明でした(Denning
et al., Nature, 488, 226-230, 2012)。そこで、当研究室ではアラキドン酸による細胞死経路を明らかにすることを目的として分子生物学的に研究を勧めています。この成果は、カフェインは抗ガン剤の効果を高めること(Tomita
and Tsuchiya, Jpn. J. Cancer Res. 80, 83-88, 1989)から、新たな抗ガン剤補助薬の開発につながることも期待されています。
カフェインによる細胞死の情報伝達カスケード
ソリトン波様多細胞運動の解析
ソリトンとは波紋の広がりに見られるように安定な波を生成する日常ありふれた物理現象であり、これまで様々な現象の中に存在することが確認されています。現在では光ファイバー通信の長距離化などへの応用も研究されており、この現象を取り扱う数学、理論物理学、光伝達においては非線形の現象を説明する非常に重要な基礎概念となっています。桑山研究室では、上述の研究過程において土壌アメーバである細胞性粘菌のある突然変異株が細胞運動集団にソリトン現象が観察されるのを発見しました(下写真)。この突然変異株は飢餓状態で集合せず、下写真のように波状の細胞集団を形成する。この写真では左右から波状の細胞集団が近づき衝突後、互いの形を維持したまま独立に運動しています。この現象は、飢餓状態におけるなんらかの多細胞体運動を反映しているものであると推測はできますが、その機能や生成メカニズムの全体像は不明です。当研究室においては、この突然変異株の変異遺伝子を特定し生物学的ソリトン現象にどのような遺伝子が関与するかを遺伝学的、分子生物学的に解明し、運動の分子メカニズムの解明を行っています。
ソリトン様多細胞運動

細胞性粘菌ミトコンドリア由来新規ガン抑制因子の解析
細胞ガン化の多くは、増殖と分化の切換え機構における異常と考えられています (Pettersson et al., Cell Death and Differ., 18, 1231-1233, 2011)。生物の発生過程では細胞が分化を開始すると増殖能低下させる厳密な機構が存在しますが、ガン細胞ではこの機構が破綻し、無秩序に細胞分裂を繰り返します。これまで、細胞性粘菌 (Dictyostelium discoideum) を利用しこれまで切換え機構に関わる分子同定のため、厳密な細胞周期同調培養系を確立し細胞が増殖から分化に移行するときに特異的に発現される遺伝子産物を同定されました(Chida et al., BMC Genetics, 2008; Mayanagi et al., Dev. Genes Evol., 2004)。それらのうちのひとつミトコンドリア・リボゾームタンパク質様遺伝子S4(Ddmrp4) 分子は、増殖の停止と分化の開始のカギとなる重要な機能を果たしていることが明らかになりました (Maeda and Chida, Biomolecules, 2013)。このDdMRP4はそれまで知られていたリボソームタンパク質と相同性が低く、ミトコンドリア内で合成されるものの分子内に核移行シグナルを有し、核内で増殖と分化の切換えに深く関わっていることが推測されています(Maeda, Dev. Growth Differ., 2011)。細胞性粘菌とヒトでは遺伝子レベルで多くの共通点が存在しますが、ヒトにはDdMRP4と相同な遺伝子はありません。しかしながら、Ddmrp4遺伝子をヒト癌細胞に強制発現させDdmrp4遺伝子のガン細胞への影響を検討したところ、面白いことにアポトーシス(プログラムされた細胞死)が誘導されることにより増殖が抑制されました。一方、非ガン由来の培養細胞の増殖にはほとんど影響を与えなかった。これらの研究成果は、DdMRP4がガン細胞特異的に作用する細胞死誘導因子として働くことを強く示すものです。桑山研究室では現在、新規ガン抑制因子DdMRP4のガン治療薬への応用をめざし、見つかったガン特異的なアポトーシス誘導機構を遺伝子レベルで解析することを行っています。
相同性組換え効率の上昇化
桑山研究室ではこれまでにDNAオリゴマーを利用した形質転換における相同性組み換え効率化に成功しています(Kuwayama, et al, J. Biotechnology, 2008)。現在はオリゴマーを工夫することによりさらなる効率の上昇化に取り組んでいます。
筑波大学生命環境系 桑山研究室
〒305-8572
茨城県つくば市天王台1−1−1
TEL 029-853-4664
FAX 029-853-6614